[Kimya] Periyodik Cetvel – Periyodik Tablo | Periyodik Cetvel Tarihçesi – Guruplar Ve Özellikleri – Mendeleyev’in Hazırladığı İlk Periyodik Ta..
Hale - 4 Aralık 2015 Fizik, Kimya ve Biyoloji 0 0 Okunma : 3603
İçerik Hakkında Bilgi
- Bu içerik 27.05.2010 tarihinde Hale tarafından, Fizik - Kimya - Biyoloji Konu Anlatımları bölümünde paylaşılmıştır ve 4735 kez okunmuştur.
Kaynak: Kadim Dostlar ™ Forum
İçerik ve Kategori Araçları
- Kategoriye Abone Ol
- Makalenin Çıktısını Al
- Makaleye Yorum ekle
- Son Güncellenme Tarihi: 24 Kasım 2015, Salı 10:56
Periyodik Cetvel – Periyodik Tablo
19. yüzyıl başlarında kimyasal çözümleme yöntemlerinde hızlı gelişmeler elementlerin ve bileşiklerin fiziksel ve kimyasal özelliklerine ilişkin çok geniş bir bilgi birikimine neden oldu. Bunun sonucunda bilim adamları elementler için çeşitli sınıflandırma sistemleri bulmaya çalıştılar.
Rus kimyacı Dimitriy İvanoviç Mendeleyev 1860’larda elementlerin özellikleri arasındaki ilişkileri ayrıntılı olarak araştırmaya başladı.
Bakınız, Dimitri İvanoviç Mendeleev
1869’da, elementlerin artan atom ağırlıklarına göre dizildiklerinde özelliklerinin de periyodik olarak değiştiğini ifade eden periyodik yasayı geliştirdi ve gözlemlediği bağlantıları sergilemek için bir periyodik tablo hazırladı. Alman kimyacı Lothar Meyer de, Mendeleyev’den bağımsız olarak hemen hemen aynı zamanda benzer bir sınıflandırma yöntemi geliştirdi. Mendeleyev’in periyodik tablosu o güne değin tek başına incelenmiş kimyasal bağlantıların pek çoğunun birlikte gözlemlenmesini de olanaklı kıldı. Ama bu sistem önceleri pek kabul görmedi. Mendeleyev tablosunda bazı boşluklar bıraktı ve bu yerlerin henüz bulunmamış elementlerle doldurulacağını ön gördü. Gerçekten de bunu izleyen 20 yıl içinde skandiyum, galyum ve germanyum elementleri bulunarak boşluklar doldurulmaya başlandı.
Mendeleyev’in hazırladığı ilk periyodik tablo 17 grup (sütun) ile 7 periyottan oluşuyordu ; periyotlardan, potasyumdan broma ve rubidyumdan iyoda kadar olan elementlerin sıralandığı ikisi tümüyle doluydu ; bunun üstünde, her birinde 7 element bulunan (lityumdan flüora ve sodyumdan klora) iki kısmen dolu periyot ile altında üç boş periyot bulunuyordu. Mendeleyev 1871 de tablosunu yeniden düzenledi ve 17 elementin yerini (doğru biçimde) değiştirdi. Daha sonra Lothar Meyer ile birlikte, uzun periyotların her birinin 7 elementlik iki periyoda ayrıldığı ve 8. gruba demir, kobalt, nikel gibi üç merkezi elementin yerleştirildiği 8 sütunluk yeni bir tablo hazırladı.
Lord Rayleigh (Jonh William Strutt) ve Sir William Ramsay‘in 1894 den başlayarak soygazlar olarak anılan helyum, neon, argon, kripton, radon ve ksenonu bulmalarından sonra, Mendeleyev ve öbür kimyacılar periyodik tabloya yeni bir “sıfır” grubunun eklenmesini önerdiler ve sıfırdan sekize kadar olan grupların yer aldığı kısa periyotlu tabloyu geliştirdiler. Bu tablo 1930’lara değin kullanıldı.
Daha sonraları elementlerin atom ağırlıkları yeniden belirlenip periyodik tabloda düzeltmeler yapıldıysa da, Mendeleyev ile Meyer‘in 1871 deki tablolarında özelliklerine bakılarak yerleştirilmiş olan bazı elementlerin bu yerleri, atom ağarlıklarına göre dizilme düzenine uymuyordu. Örneğin argon – potasyum, kobalt – nikel ve tellür – iyot çiftlerinde, birinci elementlerin atom ağırlıkları daha büyük olmakla birlikte periyodik sistemdeki konumları ikinci elementlerden önce geliyordu. Bu tutarsızlık atom yapısının iyice anlaşılmasından sonra çözümlendi.
Yaklaşık 1910’da Sir Ernest Rutherford’un ağır atom çekirdeklerin- den alfa parçacıkları saçılımı üzerine yaptığı deneyler sonucunda çekirdek elektrik yükü kavramı geliştirildi. Çekirdek elektrik yükünü elektron yüküne oranı kabaca atom ağırlığının yarısı kadardı. A. van den Broek 1911’de, atom numarası olarak tanımlanan bu niceliğin elementin periyodik sistemindeki sıra numarası olarak kabul edilebileceği görüşünü ortaya attı. Bu öneri H.G.J. Moseley’in pek çok elementin özgün X ışını tayf çizgi- lerinin dalga boylarını ölçmesiyle doğrulandı. Bundan sonra elementler periyodik tabloda artan atom numaralarına göre sıralanmaya başladı. Periyodik sistem, Bohr’un 1913’te başlattığı atomların elektron yapıları ve tayfın kuvantum kuramı üzerindeki çalışmalarla açıklığa kavuştu.
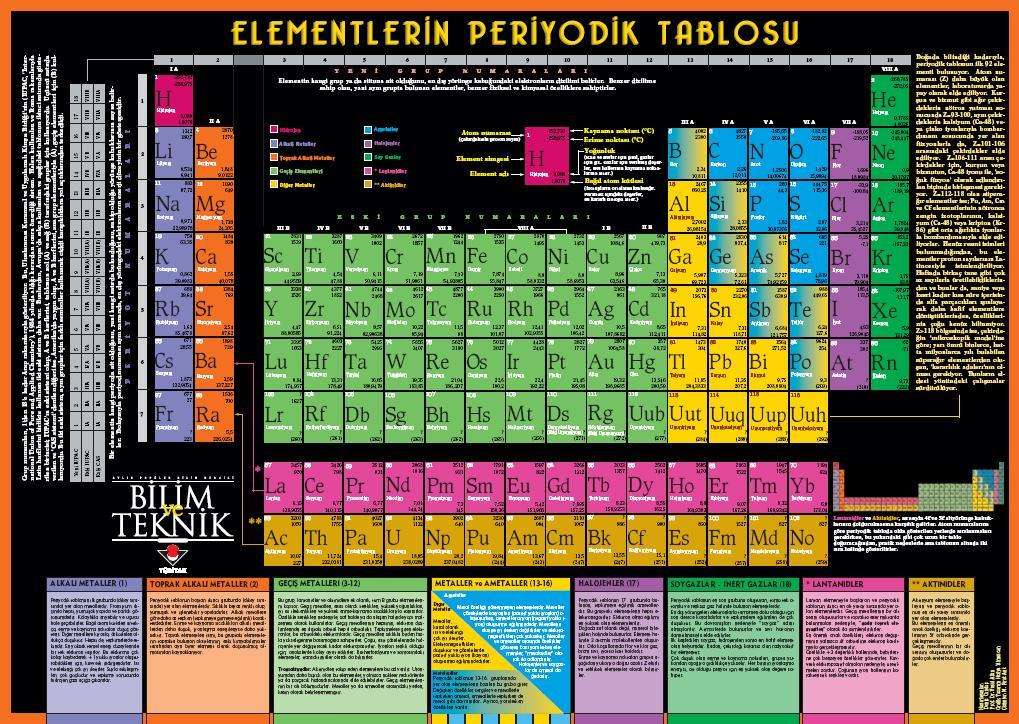
Periyotlar.
Periyodik sistemin bugün kullanılan uzun Periyotlu biçiminde, doğal olarak bulunmuş ya da yapay yolla elde edilmiş olan 107 element artan atom numaralarına göre yedi yatay periyotta sıralanır ; lantandan (atom numarası 57) lütesyuma (71) kadar uzanan lantanitler dizisi ile aktinyumdan (89) lavrensiyuma (103) aktinitler dizisi bu periyotların altında ayrıca sıralanır. Periyotların uzunlukları farklıdır. İlk periyot hidrojen periyodudur. Ve burada hidrojen (1) ile helyum (21) yer alır. Bunun ardından her birinde 8 element bulunan iki kısa periyot uzanır. Birinci kısa periyotta lityumdan (3) neona (10) kadar olan elementler, ikinci kısa periyotta ise sodyumdan (11) argona (18) kadar olan elementler yer alır. Bunları, her birinde 18 elementin bulunduğu iki uzun periyot izler. Birinci uzun periyotta potasyumdan (19) kriptona (36), ikinci uzun periyotta rubidyumdan (37) ksenona (54) kadar olan elementler bulunur. Sezyumdan (55) radona (86) kadar uzanan 32 elementlik çok uzun altıncı periyot, lantanitlerin ayrı tutulmasıyla 18 sütunda toplanmıştır ve özellikleri birinci ve ikinci uzun periyottaki elementlerinkine çok benzeyen elementler bu elementlerin altında yer alır. 32 elementlik en son uzun periyot tamamlanmamıştır. Bu periyot ikinci en uzun periyottur ve atom numarası 118 olan elementlerle tamamlanacaktır.
Gruplar.
Helyum, neon, argon, kripton, ksenon ve radondan oluşan altı soy gaz, tümüyle dolu altı periyodun sonunda yer alır ve bunlar periyodik sistemin 0 grubunu oluştururlar. Lityumdan flüora ve sodyumdan klora kadar uzanan ikinci ve üçüncü periyottaki yedişer element ise sırasıyla I., II., III., IV., V., VI., VII. grupları oluştururlar. Dördüncü periyotta yer alan, potasyumdan broma kadar sıralanan 17 elementin özellikleri farklıdır. Bunların periyodik sistemde 17 alt grup oluşturdukları düşünülebilir, ama bu elementler geleneksel olarak 15 alt grupta toplanırlar ve demir, kobalt, nikel ve bundan sonraki periyotta benzer özellikte olan elementler tek bir grupta, VIII. Grupta yer alırlar. Potasyumdan (19) manganeze (25) kadar olan elementler sırasıyla Ia, IIa, IIIa, IVa, Va, VIa, VIIa alt gruplarında, bakırdan (29) broma (35) kadar olan elementler de Ib, IIb, IIIb, IVb, Vb, VIb, VIIb, alt gruplarında toplanırlar.
I. grup alkali metaller grubudur ; lityum ve sodyumun yanı sıra potasyumdan fransiyuma kadar inen metalleri kapsayan bu grup, farklı özelliklere sahip Ib grubu metallerini içermez. Aynı biçimde, berilyumdan radyuma kadar inen elementleri kapsayan II. grup toprak alkali metallerdir ve IIb grubundaki elementleri kapsamaz. III. grubu oluşturan bor grubu elementlerinin özellikleri, IIIa grubunun mu yoksa IIIb grubunun mu, bu grupta yer alacağı sorusuna kesin bir yanıt getirmez, ama çoğunlukla IIIa grubu elementleri bor grubu olarak düşünülür. IV. grubu karbon grubu elementleri oluşturur ; bu grup silisyum, kalay, kurşun, gibi elementleri kapsar. Azot grubu elementleri V. grupta toplanmışlardır. VI. grup oksijen grubu elementlerinden, VII. grup ise halojenlerden oluşur.
Hidrojen elementi bazı tablolarda Ia grubunda gösterilmekle birlikte kimyasal özellikleri alkali metallere ya da halojenlere çok benzemez ve elementler arasında benzersiz özelliklere sahip tek elementtir. Bu nedenle hiç bir grubun kapsamında değildir.
Uzun periyotların (4., 5. Ve 6. periyotlar) orta bölümünde yer alan IIIb, IVb, Vb, VIIb, Ib gruplarındaki ve VIII. gruptaki 56 elemente geçiş elementleri denir.
Bir Periyotta Soldan Sağa Doğru Gidildikçe ;
a) Atom no, kütle no, proton sayısı, atom kütlesi, nötron sayısı, elektron sayısı, değerlik elektron sayısı artar.
b) Atom çapı ve hacmi küçülür.
c) İyonlaşma enerjisi artar.
d) Elektron ilgisi ve elektronegatifliği artar. (8A hariç)
e) Elementlerin metal özelliği azalır, ametal özelliği artar. (8A hariç)
f) Elementlerin oksitlerinin ve hidroksitlerinin baz özelliği azalır, asitlik özellik artar. (8A hariç)
g) Elementlerin indirgen özelliği azalır, yükseltgen özelliği artar. (8A hariç)
Bir Grupta Yukarıdan Aşağıya Doğru İnildikçe ;
a) Proton sayısı, nötron sayısı, elektron sayısı, çekirdek yükü, Atom no, Kütle no artar.
b) Atom çapı ve hacmi büyür.
c) Değerlik elektron sayısı değişmez.
d) İyonlaşma enerjisi, elektron ilgisi ve elektronegatiflik azalır.
e) Elementlerin metal özelliği artar, ametal özelliği azalır.
f) Elementlerin, oksitlerin ve hidroksitlerin baz özelliği artar, asit özelliği azalır.
g) Elementlerin indirgen özelliği artar, yükseltgen özelliği azalır
Kaynak: Kadim Dostlar ™ Forum
Bu içerik 27.05.2010 tarihinde Hale tarafından, Fizik - Kimya - Biyoloji Konu Anlatımları bölümünde paylaşılmıştır ve 4735 kez okunmuştur. Bu içeriğin devamında incelemek isteyebileceğiniz 6 adet mesaj daha bulunmaktadır.
[Kimya] Periyodik Cetvel - Periyodik Tablo | Periyodik Cetvel Tarihçesi - Guruplar Ve Özellikleri - Mendeleyev\'in Hazırladığı İlk Periyodik Tablo - Elementler Nasıl İsimlendiriliyor? Periyodik Tablo Bize Neler Anlatıyor? orjinal içeriğine ulaşmak için tıklayın ...
